2019年,一个跨国研究团队宣布一则爆炸性结果:他们已将人类细胞植入猴子的胚胎内,成功培育出全球第一个人猴混种胚胎。
这一研究结果立马在世界范围内引起巨大的争议。毕竟,如果人-动物嵌合胚胎经发育后,产生与人类相似的具有意识能力的神经系统,甚至表现出与人类相似的行为,由此产生的伦理后果是难以想象的。
近日,昆明理工大学灵长类转化医学研究院季维智院士团队,在之前的研究基础上,将人类干细胞注射到灵长类动物食蟹猴的胚胎中,神奇的是嵌合胚胎存活了近20天。
2021年4月15号,《Cell》发布题目名为“Chimeric contribution of human extended pluripotent stem cells to monkey embryos ex vivo ”,宣布构建了世界首个人-猴嵌合体胚胎。这项研究是人类首次在体外制造出了人猴嵌合胚胎,为体外大量制备人类多能干细胞提供了新希望。

得到伦理许可之后,研究人员先将25个已被荧光标记的人类扩展多功能干细胞(EPSC)注射进受精6天后的猕猴胚胎囊胚中,随后检测胚胎中是否有人类干细胞的表达。
受精1天后发现接受EPSC注射的132个猕猴囊胚均出现了荧光蛋白,可见EPSC的注射成功率非常高。受精10天后仍有103个嵌合胚胎在发育中,这些囊胚在着床后继续生长,并形成胚盘。
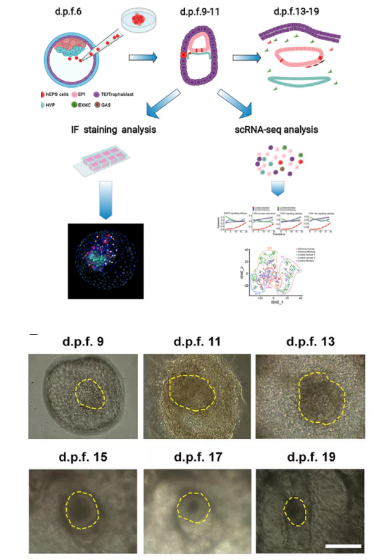
下一步,研究者观察EPSC在胚盘中的生存情况。随着培养时间的延长,EPSC荧光蛋白在胚盘中的含量逐渐降低,但在受精13天后,占比仍接近40%。同时还发现,注射 EPSC导致的人猴嵌合仅略微降低胚盘的存活率(与对照组相比)。
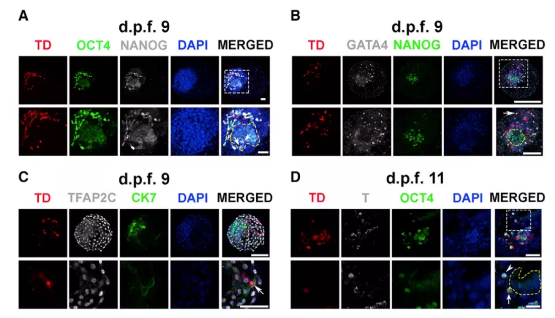
在受精9天后的胚盘中,平均约10.2个的EPSC被成功整合到猕猴胚胎的内细胞团中。大多数EPSC并不表达NANOG,证明其更接近于人猴嵌合胚胎的上胚层细胞,仅有极少量的EPSC出现在滋养外胚层中。
在受精11天后的胚盘中,表达OCT4的EPSC逐渐出现在上胚层。同时,下胚层中也出现一些表达下胚层标记物的EPSC。
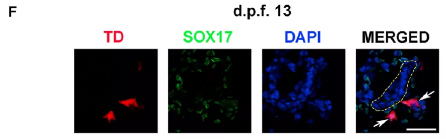
在受精13天后的胚盘中,开始出现表达SOX17的ESPC,说明ESPC逐渐形成原肠胚。
随后对这些胚胎进行了单细胞RNA测序(scRNA-seq),以进一步探究人猴嵌合胚胎的发育轨迹。
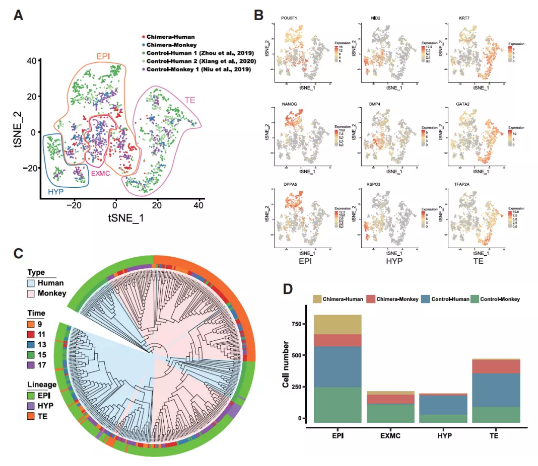
对不同发育时间点的227个人类细胞与302个猕猴细胞进行 scRNA-seq,终选取了200个人类细胞与272个猕猴细胞进行进一步分析。
首先进行了T -分布邻域嵌入(t-SNE)算法分析。结果显示,人猴嵌合胚胎中的人和猴的细胞都被分为上胚层(EPI)、下胚层(HYP)、滋养外胚层(TE)以及胚外间充质细胞(EXMC)这4个细胞群,这点和人或者猴的胚胎一致。
在人猴嵌合胚胎中,4种猕猴细胞群全部出现,说明猴的胚胎发育基本未受到EPSC注射的影响。
不同的是,在人猴嵌合胚胎中,人类细胞4个细胞群,但上胚层细胞、下胚层细胞以及滋养外胚层细胞之间的界限没有猴细胞那样明显。
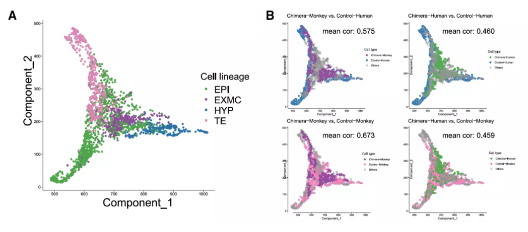
随后的转录动力学研究显示,人猴嵌合体中的人类细胞与对照组的人类胚胎及猴胚胎分别比较,得出的相关系数几乎无差别。可见人猴嵌合体中的人类细胞越来越接近猴细胞。
进一步的谱系相关矩阵显示,人猴嵌合胚胎中的人类下胚层与胚外间充质细胞与人猴嵌合胚胎中的猴下胚层与胚外间充质细胞表现出高度相关性。证明在人猴嵌合胚胎中,人和猴胚胎细胞的转录状态是互相影响的。
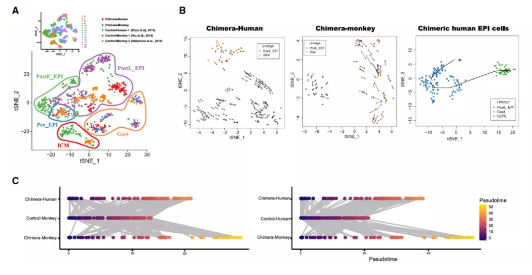
后,研究团队探究了上胚层EPSC在人猴嵌合胚胎中的发育轨迹。与人类胚胎或猴胚胎中真正的胚胎细胞相比,EPSC分化成类上胚层细胞的效率更低,且速度更慢。
总的来说,这项研究再一次证实人猴嵌合胚胎是可行的,更重要的是发现“杂交”胚胎正常发育后人类细胞的占比也能达到预期。
但是,胚胎实验一直有个默认法则,科学界在进行人兽嵌合体胚胎实验的时候,会在第14天将其处死,即禁止人工胚胎生长超过 14 天。这个法则被称为“两周法则”或者“14天法则”。
因为这个法则,人类-动物嵌合体胚胎技术的未来将何去何从,我们也不得而知。









